Se zvyšováním průměrné délky života a stárnutím populace jde ruku v ruce i častější výskyt patologií negativně ovlivňujících naši centrální nervovou soustavu, tedy mozek a míchu. Jedním z onemocnění, která postihují mozek, je cévní mozková příhoda neboli mrtvice, která je celosvětově jednou z hlavních příčin úmrtí a trvalé invalidity. Jen v České republice přibude kolem 25000 případů cévní mozkové příhody ročně, přičemž tomuto onemocnění podlehne téměř 8000 pacientů.
Existují dva typy cévní mozkové příhody: hemoragická, která je doprovázena krvácením do mozku, a ischemická, které se hlouběji věnujeme v Oddělení buněčné neurofyziologie Ústavu experimentální medicíny AV ČR, v.v.i. Ischemie vzniká důsledkem nedostatečného prokrvení nervové tkáně, což je nejčastěji způsobeno ucpáním určité cévy mozku krevní sraženinou. Bohužel i v dnešní době moderní medicíny jsou léčebné přístupy pro toto onemocnění velmi omezené. Po rychlém převozu pacienta do nemocnice tak mají lékaři k dispozici pouze takzvanou „rekanalizaci“ cévy, což znamená enzymatické rozpuštění sraženiny nebo její operační vynětí, čímž se obnoví průtok krve v postižené cévě. A právě kvůli nedostatku léčebných přístupů se v rámci výzkumného programu Strategie AV21 s názvem Genová a přesná terapie – nová naděje v léčbě lidských chorob snažíme pomoci nervové tkáni postižené ischemií jiným způsobem, konkrétně podpořením neurogeneze (tedy přeměny jiného buněčného typu v neurony) a tím i regenerace ischemií zasažené oblasti mozku.
K tomu používáme různé laboratorní metody a technologie, které nám pomáhají při hledání nových možností, jak léčit cévní mozkovou příhodu. V první řadě hledáme nejvhodnější buněčné kandidáty na přeměnu v neurony, které jsou nejcitlivější k nedostatku kyslíku a při mozkové ischemii odumírají jako první. Takovéto buňky mohou být při správné stimulaci zdrojem nově vzniklých neuronů, které nahradí neurony odumřelé. K tomu nám pomáhají laboratorní myši, které mají geneticky zakódované fluorescenční proteiny, specificky v každém buněčném typu v mozku. To v praxi znamená, že umíme na základě barvy buňky rozlišit na neurony, ale také gliové buňky, které se dále dělí na astrocyty, mikroglie, oligodendrocyty a polydendrocyty. Například polydendrocyty, což jsou glie, které za fyziologických podmínek dávají vznik myelinizujícím oligodendrocytům, máme značené červenou fluorescenční značkou zvanou Tomato. Za patologických podmínek, například právě při ischemii mozku, se ale tzv. diferenciační potenciál polydendrocytů mění a tyto buňky mohou dávat vznik také jiným buněčným typům. Jsou proto ideálními kandidáty na přeměnu v neurony. Myši se značenými buněčnými typy nám zároveň slouží jako model cévní mozkové příhody ischemického typu, kterou u nich vyvoláváme operačně a následně porovnáváme buňky těchto myší s neoperovanými (zdravými) kontrolami.
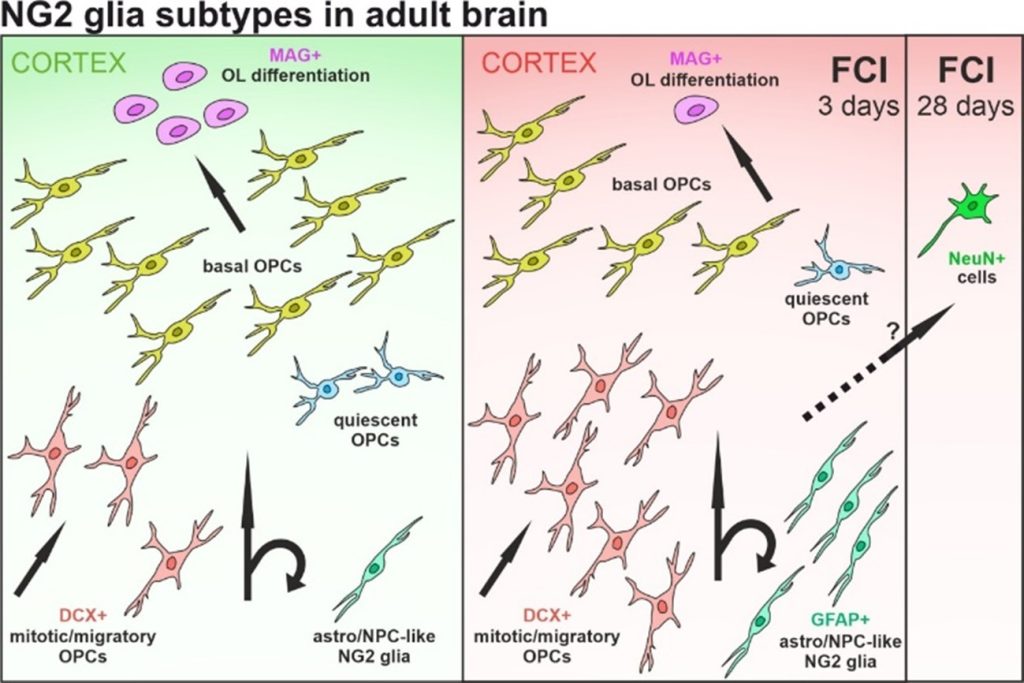
Obrázek: Grafický abstrakt znázorňující naše nedávná zjištění, že polydendrocyty (také nazývané NG2 glie) vykazují některé vlastnosti neuronů, a to specificky již 28 dní po ischemickém poškození mozku neboli fokální cerebrální ischemii (FCI) u myší (DOI: 10.1002/glia.24471).
V naší nedávné studii jsme za pomoci analýzy genů, proteinů a funkčních vlastností buněk zjistili, že právě polydendrocyty vykazují některé vlastnosti neuronů specificky u ischemických myší. To naznačuje, že se mozek po cévní mozkové příhodě snaží sám „přeprogramovat“ své buňky v neurony. Zcela přeměněnou gliovou buňku se nám však nepodařilo najít, což zase může nasvědčovat tomu, že mozek nemá sám o sobě kapacitu dovést proces neurogeneze z polydendrocytů do úspěšného konce. Právě proto jsme se s kolegy z výzkumného programu Strategie AV21 rozhodli, že tyto „nerozhodné“ polydendrocyty zkusíme „přesvědčit“, aby se staly neurony. K tomuto cíli nám dopomůže modifikovaná mRNA, která by mohla sloužit jako moderní a bezpečný přístup pro přeprogramování buněk. Tento terapeutický přístup má velkou výhodu oproti virovým nosičům, které se mohou začlenit do genomu nebo přetrvávat v organizmu dlouhou dobu, což jsou pro naše účely nežádoucí jevy. Zároveň se technologie mRNA velmi osvědčily i v době pandemie Covid-19, kdy pomohly vytvořit účinné vakcíny proti tomuto onemocnění. Proto věříme, že by tento přístup mohl vhodně doplnit již existující léčbu cévní mozkové příhody.
Autor: Mgr. Ján Kriška, Ph.D. ve spolupráci s Mgr. Janou Turečkovou, PhD a Ing. Miroslavou Anděrovou, CSc.
Oddělení buněčné neurofyziologie, Ústav experimentální medicíny AV ČR, v. v. i.
